又一款国产CAR-T疗法在国内获批。
3月1日,CAR-T细胞疗法公司科济药业(2171.HK)对外宣布,国家药品监督管理局已经正式批准泽沃基奥仑赛注射液的新药上市申请,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
泽沃基奥仑赛注射液是一款靶向BCMA的自体CAR-T产品,这是继复星凯特的阿基仑赛注射液,药明巨诺(02126.HK)的瑞基奥仑赛注射液、信达生物(1801.HK)与驯鹿生物的伊基奥仑赛注射液以及合源生物的纳基奥仑赛注射液之后,国内获批的第五款CAR-T疗法。
科济药业首款商业化产品:价格未披露,华东医药是合作方
科济药业成立于2014年,专注于治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法,2021年6月在港股上市。根据2023半年报,科济药业拥有十余个在研产品,此次泽沃基奥仑赛注射液走在最前面,也是该公司获批的第一款产品。科济药业创始人李宗海评价,在科济成立十年之际,泽沃基奥仑赛注射液的成功获批上市是公司发展历程中的重要里程碑。
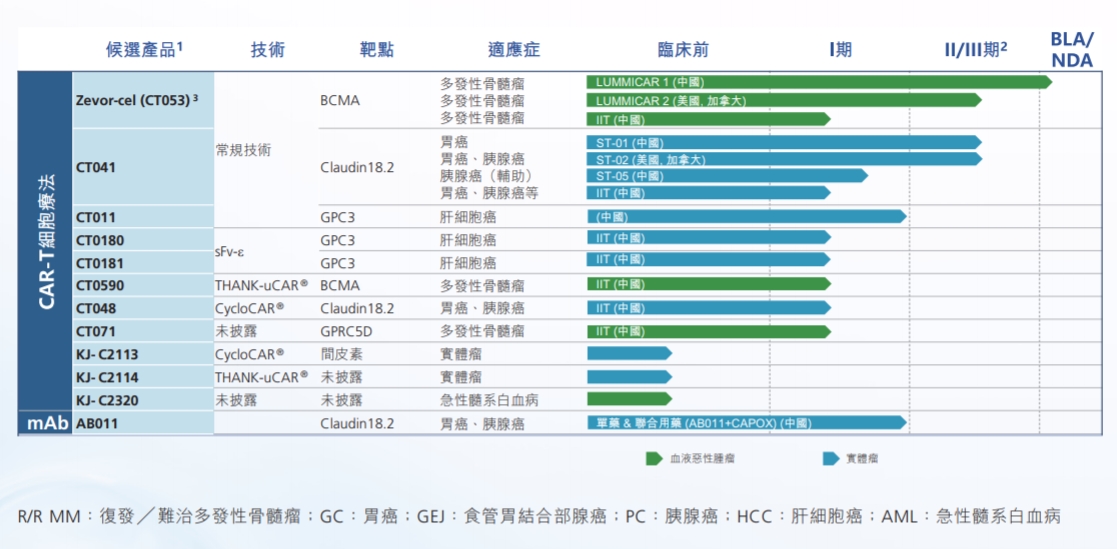
科济药业产品管线 来源:2023年半年报
CAR-T疗法属于细胞免疫疗法,是在体外利用基因工程的方法修饰患者外周血T细胞,赋予T细胞靶向识别肿瘤细胞表面抗原的特性 ,经体外扩增培养后回输到患者体内进行治疗肿瘤的方法。简单来说,就是利用人体免疫细胞抗癌,有“抗癌神药”之称。
CAR-T疗法的价格普遍在百万级别,此前合源生物的纳基奥仑赛注射液被曝价格降至百万以下,为99.9万元。对于科济药业CAR-T疗法的价格,澎湃新闻记者3月1日联系了李宗海,他表示,目前价格还无法对外透露。
在商业化方面,科济药业的合作伙伴是华东医药(000963)。2023年1月16日,华东医药全资子公司华东医药(杭州)与科济药业控股有限公司的全资子公司恺兴生命签订了产品独家商业化合作协议。华东医药(杭州)获得泽沃基奥仑赛注射液于中国大陆的独家商业化权益。华东医药(杭州)向恺兴生命支付2亿元人民币首付款,以及最高不超过10.25亿元人民币的注册及销售里程碑付款。
从获批适应证来看,目前五款国产CAR-T疗法的适应证不尽相同。复星凯特和药明巨诺的CAR-T疗法针对的是淋巴瘤,合源生物则针对白血病。科济药业和驯鹿生物的CAR-T疗法针对的是多发性骨髓瘤。多发性骨髓瘤是一种难治性的恶性浆细胞疾病,约占所有血液肿瘤的10%。据Frost and Sullivan估计,2023年中国多发性骨髓瘤的患病人数大约为15.3万人,新发病例数为2.32万人,预计中国多发性骨髓瘤的患病人数于2030年将增长至26.63万人。
CAR-T疗法被FDA加黑框警告,科济药业等多方回应
CAR-T疗法在肿瘤治疗领域展现了强大的有效性,但安全性在最近几个月受到外界关注。
2024年1月,美国食品药品监督管理局(FDA)直接向六款已上市的CAR-T疗法发送安全标签变更函,要求其添加T细胞癌症风险的黑框警告。更早之前的2023年11月,FDA公告称,将调查关于接受靶向BCMA或CD19自体CAR-T细胞免疫疗法治疗的患者出现T细胞恶性肿瘤(包括嵌合抗原受体CAR阳性淋巴瘤)的风险,已经确认目前批准的所有靶向BCMA和CD19的CAR-T疗法都有该风险。
对此,国家药监局2月7日曾回应称,考虑到CAR-T产品的特性,我国在批准四款CAR-T产品上市时,均已在说明书的“注意事项”中提示使用本品治疗后,存在发生继发性恶性肿瘤的可能性,并提示患者需终身监测继发性恶性肿瘤,在发现继发性T细胞相关恶性肿瘤时联系相关药品上市许可持有人,以获取进行相关样本采集及检测的指导。
对于自家产品的安全性,科济药业在官方通稿中提到,公司CAR-T疗法的获批是基于一项在中国进行的开放标签、单臂、多中心二期的临床试验。根据2022年美国血液学会公布的试验结果,产品表现出令人鼓舞的疗效和良好的安全性。
此前李宗海在接受澎湃新闻记者采访时表示,FDA此次的调查对做自身免疫性疾病的CAR-T公司可能冲击更大一些,对做肿瘤适应证的公司影响相对较小。CAR-T的技术发展空间很大,将来还可以通过技术进一步改造提高产品的安全性,这也是企业可以做的方向。
科济药业还在推动CAR-T疗法在海外市场的研发,2023半年报提到,该药在美国及加拿大进行的2期临床试验的入组正在进行中。不过,海外进展也有波折。
2023年12月,科济药业曾公告称,科济药业在美国的子公司收到FDA通知,要求暂停CT053、CT041和CT071的临床试验,等待位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。上述三款在研产品均为CAR-T疗法,其中CT053就是此次在国内获批的CAR-T疗法。
2023年12月13日,科济药业向澎湃新闻记者表示,FDA本次并未针对公司临床数据提出疑问,此次FDA的专业建议主要是因CMC(化学、制造和控制)相关问题,有些员工培训等遗留问题需进行合规完善,并非针对工艺问题,这也让公司有了明确的观察项,帮助公司更有针对性地提升。公司有信心很快完成,会尽快将整改方案提供给FDA,后续保持交流,并落实整改。
截至3月1日收盘,科济药业跌0.6%,报收6.62港元,市值38.1亿港元。