 Watch and learn, your magic is mine!
查看知乎原文
Watch and learn, your magic is mine!
查看知乎原文
谢邀。如果只是对高中生而言,这是一个很简单的问题。对大学非化学专业学生,也是容易回答的。但是对于研究生以后,这里可以引出很多东西,实在太宏大了,我在考虑要不要把我的毕业论文贴上来。
额,发现自己好像弄错了一个概念,谢谢评论区朋友批评指正。我没有严格区分化合价和氧化态的概念,这是不对的,以下讨论其实主要是针对氧化态进行的。
这主要是因为化合价是一个非常非常早期的概念,在人们还不清楚原子间是怎么成键,分子轨道试是怎么回事的时候,提出的一个总结实验规律的好东西。主要是指原子倾向于与其周围的原子形成几根键的能力。在这个概念的基础上,后续才逐渐发展出了氧化态的概念,以及价键理论,分子轨道理论,到现在的量子化学。我心目中一直是把这两个概念混用的,看来是我背离教材了……
因为我好久没有看教科书了,所以不知道现在高中是怎么教的……根据评论区意见,我推测在经典离子化合物中,教材认为的化合价就是氧化态。在共价化合物中,化合价是指原子成几根键,氧化态是指原子电子云的偏向情况?如果真是这样,真的是好糟糕的定义……一个 CO 中 C-O 之间是几根键就能让学生大伤脑筋好么……
不过我也只是小人物,没有吐槽教材的权利,所以如果我写得有与现行教材冲突的地方,请各位务必告诉我,我不能误人子弟。以下是原来我关于氧化态的讨论,各位可以看看,请自行脑补将下文提到的化合价改成氧化态,改不过来了……
当今化学界,不是一天两天有人诟病氧化态的定义有问题了,甚至 IUPAC 都出动要重新修订此定义了,不过我最近看了他们委托人发的总结报告,还是任重道远,修补一个浅显易懂而又具有普适性的概念太难了。
// 关于现行的氧化态的定义,请自行查阅教科书或者 IUPAC 的定义。//
首先从题主提问水平来看,应该属于高中生。对于这个阶段的学习,化合价(氧化态)概念有两个作用。
第一是方便理解教科书提到的八电子规则,得失电子最后的结果是形成具有稳定结构(八电子)的离子,此时原子所带的净电荷数目就是其对应的化合价,对于经典化合物,按照其对应化合价,每个原子都是符合八电子规则的。然后因为你给电子只能给分子内的其它原子,你给多少,它就拿多少,所以和必然为零。例如咱们打牌,你输钱给我,不论你输多少,咱们两个人钱总和不还是不变的么。
第二是方便配平氧化还原反应的方程式,谁用谁知道,这就不展开了,如果不会请去问老师……
以下讨论基于大学化学知识开始,应付高中考试掌握以上即可。
化合价最早定义是基于无机化合物的,或者更准确点,是基于离子型化合物的。一个经典的例子是用来解释的 NaCl 是如何形成的,结构是怎么样的。具体请见
和
等其他答案,感谢他们精彩的回答。
但是化合物不仅有离子型,还有共价型,甚至到了现代化学中的金属有机化学部分,各种奇葩分子层出不穷,甚至都不能简单划分为离子型还是共价型了,在这种情况下,从离子型化合物延伸出来的关于化合价的定义就出了问题。
举一个例子,N2O 中 N 和 O 的化合价是多少?这不是一个很难的问题,但是有意思的是,很多人会就此产生争议。
例如,有人认为,根据定义,一般认为 O 为 -2 价,分子是不带电荷的,那么 N 应该为 +1 价;有人会提出质疑,因为 N2O 中两个 N 原子的化学环境是不同的,是呈 N-N-O 这样子的,那么显然跟 O 相连的那个 N 原子更缺电子一些,那么应该是端位 N 为 0 价,与 O 相连的 N 为 +2 价,O 为 -2 价。
谁对?这还是最简单的两元素无机化合物体系,到了复杂的金属有机化合物中又该怎么办?
这个时候就回到化合价这个概念创立之初的目的了。这个概念是总结经典离子化合物非常好的工具。说一句题外话,化学概念很多时候并不是将严谨放在第一位,而是实用性在前。
例如现代物理已经揭示了所有化学家需要的理论知识,难道我们就可以靠计算机做实验了?至少相当长一段时间内计算化学只能作为辅助手段。而且计算大部分时候相当耗时,化学家更需要简单快速地估计化合物性质的方法和理论。
化合价概念在这种背景下出现,并得到广泛接受就不奇怪了。你想啊,我知道 Mg 倾向于 +2 价,Cl 喜欢 -1 价,我就知道镁和氯气可以反应,而且至少会有二氯化镁这么个产物。通过化合价的概念,我们可以迅速掌握一大类反应,并对产物性质进行估计,这是非常有效的。
到了共价化合物,这时候由于原子间电子云交叠,电子并没有完全归属一方,所以无法像离子化合物那样呈现明显的价态规律。有人提出,这简单,离子化合物中价态本质不就是其原子的净电荷么?我类比,规定共价化合物中相应原子的价态就是其净电荷数不就好了?不就是对属于这个原子的电子云密度积分吗?物理意义也很清晰,物理学家也提供了计算方法。
这本质上没有问题,例如你可以说甲烷的 C 是正 0.3 价(随便编的数字,下同),二氧化碳的 C 是 2.7 价。也能体现不同环境下碳上电子云的情况,非常好。只有一个问题。
我总不能每次看到一个新化合物就用计算机算一次才能估计其性质吧?这么多不同数值我记不住啊!有没有简单快捷的方法定性判断一个化合物?
所以人们还是延续了化合价的概念,将其推广到共价化合物中,仍用整数描述。这时候,正负代表的是电子云密度较之原来是低了还是高了,数值代表的是与不同原子间成几根键,而不是抓走或者抢夺了多少电子。
例如水 H2O 中说 O 为 -2 价,指电子云偏向氧原子,同时其与 H 原子形成两根键。键可以是 sigma 键也可以是 pi 键。这时候数值并不体现其所带电荷多少。例如丙酮中的氧和水中的氧都是 -2,但是显然其电子结构差得很多。类似的,N 喜欢三价,共用电子成八电子总是好的,用这样的理论画出来的结构式其实就是大名鼎鼎的 Lewis 结构式了。结合化合价的概念和 Lewis 结构式,基本上经典化合物性质就能简单快速估计了。化合价的目的其实也就在此。
但是世界这么复杂,怎么可能用这么简单的概念就能概括总结?这也是 IUPAC 一直想修复和完善的工作。
先说双氧水,过硫键这种涉及到 -O-O- 或 -S-S- 这样相同原子相连的情况,现行教科书的解决方法是规定电子在二者之间平分,再根据其它规则算化合价。打上这样的补丁后似乎世界一下子美好了起来,再无漏洞了?
好了,第一个奇葩例子来了,请问金属团簇(Li4)+ 中 Li 原子是多少价?
这玩意计算研究很充分,也有实验表征支持,涉及 3c2e(三中心两电子)键。但是这些本质的东西先按下不表,请问如何解释 Li 原子的化合价,或者说氧化态?
当然硬要说正 1/4 价我也接受,但是我觉得这不体现任何化学内涵,纯粹就是为了凑数字。我个人比较喜欢的一个方案是将团簇看作一个不可拆分的整体,就是四个 Li 原子一起,总体体现 +1 价,拆开讨论单个原子化合价和电子分布没有化学意义。
再比如实验室会用到的超级活波的还原剂石墨钾 KC8。你要是跟别人说 K 为 +1 价,C 为 -1/8 价就闹笑话了。一般认为这是金属钾溶解于石墨形成的复合物,为超强还原剂,K 仍为 0 价,C8 作为整体也是 0 价。
类似团簇很多,都有 AxBy 这种形式,按数字凑价态经常会得到诡异的结果,我个人支持在了解结构的基础上,将部分原子看成一个整体的分析方法。
在金属有机化合物,或者金属配合物中,问题就更有意思了。比如最最简单的金属氢化物 MH2 这种。它是由金属配合物通入氢气形成的。
请问我应该将氢气 H2 看作一个中性分子,配位到了金属中心上,H 为 0 价;还应该是认为形成了金属氢键,从而两个 H 原子都为 -1 价呢?
关于这点,我就无耻地给自己打一个广告,可以参见我近期发表的一篇论文,在前言部分有系统阐述这个问题。
与金属氢化物类似,下面这个例子更为刁钻。
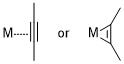
过渡金属与炔烃的配合物,到底认为是左边这种,仅仅是一个配位作用,还是应该接受是右边这个发生了氧化换金属的结构?左右两个图中,中心金属的价态可是相差 2 呢!
所以一个聪明或者说无奈的临时方案是将化合价区分为两种:1)表观氧化态(化合价);2)实验测得的氧化态(化合价)。
早期经典化合物和教科书上的例子基本二者是统一的。当面对一些奇葩分子时,我们有很多现代的测量和表征手段,例如 XPS,NMR,EPR,IR,Mössbauer spectroscopy 等。通过和公认化合价的标准化合物的测量结果进行对比分析,便可以大致归属出待测原子化合价属于哪个区间,这样的结果是可以得到公认的。
所以结果很奇怪,也很有意思。化学家们从简单的无机反应和它们的产物离子化合物出发,为了总结这些实验规律,简单粗暴地定义了化合价这个概念,即得失电子数。为了让化合价的概念延续到共价化合物,尤其是有机化合物中,陆陆续续打了很多补丁,做了不少约定,内涵发生了天翻地覆的变化。待到金属有机化合物中,表观氧化态(化合价)的概念显示出极大弊端,无法修改统一时,又提出了根据不同化合物,应该实验测量氧化态。而测量氧化态的标准又是和早期的经典离子化合物做对比。所以,化合价的本质是什么呢?