不同来源的氢分子的自由基清除活性的比较
氢气因其在众多体外和体内实验中显示出的抗氧化和抗炎特性而闻名。高分子量透明质酸(HMM HA),是一种存在于所有脊椎动物组织中的天然多糖,被用作活性氧物种降解多糖的标志物。通过DPPH测定法评估了溶解在水中的各种来源氢气的自由基清除能力。在使用旋转粘度计的实验中,HMM HA被铜离子(1 µM)和抗坏血酸(100 µM)氧化降解。此外,当·OH自由基诱导的HA降解开始前或一小时后,当烷氧基和烷过氧基型自由基诱导的HA降解占优势时,评估了各种来源的氢气的效果。DPPH测定的结果显示,在所有检查的样本中,只有溶解在蒸馏水和饮用水中的氢气片剂轻微地清除了DPP•。相比之下,旋转粘度计的实验表明,当检查在蒸馏水和饮用水中饱和的氢气时,观察到抑制活性氧物种诱导的透明质酸降解。
前言
氢气是一种无味、无臭且无毒的气体,即使在高浓度下也是如此。氢气能迅速穿过不同的组织屏障,渗透到各种细胞器,如线粒体和细胞核,以调节转录[1,2,3,4,5]。在动物模型中,氢气抑制炎症、过度的氧化应激和细胞死亡,从而保护肝脏免受各种急性和慢性损伤[1]。氢气能刺激特定的核苷酸结构域并抑制巨噬细胞中的NLRP3和炎症反应[5]。氢气的首次疾病治疗效果由Dole等人于1975年在皮肤鳞状细胞癌小鼠模型中报告[6]。
最近研究表明,氢气对脓毒症动物模型中的多个器官和生理屏障具有显著的保护作用[3]。Sim等人[7]进行了一项随机、双盲、安慰剂对照研究。健康成年人(20-59岁)被给予每天1.5 L的氢水(HW,n=20)或普通水(PW,n=18),为期4周。在年龄≥30岁的人群中,与PW组相比,HW组的生物抗氧化潜力更大。HW组外周血单个核细胞的凋亡显著减少。流式细胞术分析CD4+、CD8+、CD14+、CD20+和CD11b+细胞表明,HW组中CD14+细胞的频率降低。
使用氢气的一种医疗方法是呼吸氢测试,该测试通过测量肠道细菌产生的氢气量来进行,这些细菌由于未吸收的碳水化合物发酵而不断合成氢气。这个测试也被用作临床和科学研究中的生物标志物,包括生物化学、牙科和生理学[2]。动物实验和临床试验报告称,氢气具有放射防护效果[8]。氢气在治疗暂时性和慢性形式的氧化应激相关疲劳方面也有效[9]。在使用富含氢的透析液进行血液透析期间,血浆单核细胞趋化蛋白1和髓过氧化物酶的水平显著降低[10]。氢气最早的直接使用之一是在深海潜水中。Hydroliox是含有氢气、氦气和氧气的混合气,曾经用于潜水员水下呼吸以减少高压神经综合征[11]。氢气的第一种应用模式是使用富含氢气的高压舱[5]。现在有几种更常使用氢气的方法,包括吸入、口服富氢水(富氢水)或氢片剂,以及注射富含氢的盐水[1, 9, 10]。
通过面罩、呼吸机回路或鼻导管吸入是治疗性给予氢气的一种简单方法。吸入氢气的效果迅速,这种方法可用于治疗急性氧化应激。在大鼠实验中显示,吸入与一氧化二氮、氧气和氮气混合的氢气,动脉血中溶解的氢气水平比静脉血中的浓度更高,证明给予的氢气被纳入组织。没有证据表明吸入氢气有不良影响。尽管吸入氢气很快,但这种方法不适合日常预防性使用。因此,必须严格控制氢气浓度和剂量[4, 5, 12]。吸入氢气在慢性阻塞性肺病和严重支气管哮喘中的有益效果也已被报道。Cole等人[13]发现,在健康动物中,连续吸入含有2.4%氢气的气体混合物72小时不会导致任何生理参数的变化。2001年,Gharib等人[14]表明,吸入氢气增强了超氧化物歧化酶的催化性能。吸入氢气(空气中1%的氢气)或饮用饱和水平的氢气水减轻了顺铂(化疗药物)引起的死亡率和体重损失,并缓解了肾毒性[10]。
与气态氢气不同,溶解了氢气的水或富氢水是安全、便携且易于倍人体摄入的。在室温和大气压下,氢气可以溶解在水中,浓度高达0.8 mM(1.6 mg/L),而不会改变pH值。此浓度的氢气对小鼠模型中的肥胖有积极效果。一些研究发现饮用富氢水对疾病模型有积极作用,例如帕金森病、辐射引起的氧化损伤、口腔腭部伤口、抑郁、牙周组织老化等。临床测试显示,饮用含氢水改善了血糖和胆固醇水平高的患者的氧化应激标志物[10]。康等人[17]报告称,富氢水对于接受放疗的肝癌患者有益。在日本,氢气被认证为食品添加剂,富氢水已作为安全的饮用产品上市销售。通过电解制备的镁棒和富氢水也在接受急性/亚急性毒性和致突变性检测[10]。通过将水暴露于镁中,将电解氢气溶入水中,或在高压下将氢气溶入水中,可以容易地产生富含氢气的水[2, 4, 10]。一项关于富氢水摄入的临床研究发现,它减少了代谢综合征、2型糖尿病和葡萄糖耐量受损患者的氧化应激,并改善了脂质和葡萄糖代谢。动物研究表明,口服摄入的氢气在大约15分钟内达到血液浓度峰值,并在给药后20-30分钟恢复到基线水平。在饮用富氢水的人类中,呼出气体中的氢气浓度在大约10分钟达到峰值,并在给药后1小时恢复到基线水平[18]。Ostojic等人[19]发现,口服和局部使用富氢水两周可以减轻炎症、血清C反应蛋白、疼痛强度、肿胀程度,并提高男女运动员在急性软组织损伤后的恢复和功能能力。
尽管口服富氢水摄入氢气是安全的,但水中氢气会随着时间被消除,并且一些氢气会遗留在胃肠道内,因此很难控制摄入氢气的浓度。通过注射用氢盐水溶液给药可能允许更准确地输送氢气浓度[10]。由Ohsawa等人[20]发表的论文更显著地引起了研究人员对氢气生物和医疗效果的兴趣。该论文涉及到使用吸入氢气成功治疗缺血再灌注损伤的大鼠中风模型结果。当使用氢溶液注射时,氢气进入血液,在那里它通过捕获自由基和恢复内源性抗氧化剂来调节氧化代谢[5]。
另一种给药方式是通过眼药水给药,这减轻了大鼠视网膜的缺血再灌注损伤。在连续给药后,玻璃体中的氢气浓度增加,并且在视网膜缺血再灌注期间•OH水平降低(治疗青光眼)。氢气容易穿透皮肤并通过血流分布到全身。因此,每天泡溶解了氢气的温水浴是将氢气纳入体内的一种方式,特别是在日本[10]。
其他给药氢气的方式包括:富含氢气的纳米复合材料/微气泡、口服固态氢气缓释剂、刺激肠道微生物产生氢气、高压氢气舱、管饲富含氢气的溶液、冲洗腔体用富含氢气的水/溶液[5]。
与大多数抗氧化化合物不同,氢气能够穿过血脑屏障[10, 12]。氢气通过下调促炎和炎症细胞因子(如IL-1β、IL-6、细胞间粘附分子-1、TNF-α、NF-κB和前列腺素E2)来抑制氧化应激诱导的炎症组织损伤[1, 5, 10, 12]。氢气通过上调或下调凋亡相关因子来发挥抗凋亡作用。例如,氢气抑制促凋亡因子caspase-3、caspase-8和caspase-12、B细胞淋巴瘤-2相关X蛋白的表达,并上调抗凋亡因子B细胞淋巴瘤-2和B细胞淋巴瘤[1, 12]。氢气给药诱导多种基因的表达,包括NF-κB、N端激酶、c-Jun增殖细胞核抗原、血管内皮生长因子、胶质纤维酸性蛋白和肌酸激酶[12]。氢气似乎通过激活Nrf2途径及其后续的第二阶段抗氧化酶的诱导来发挥作用。此外,氢气调节信号转导、蛋白质磷酸化级联反应,从而调节炎症途径(NFAT、NF-κB、TLRs)、增加PGC-1α(线粒体生物发生的标记)、增强对压力的适应能力、维持线粒体膜电位和ATP产生以及影响其他信号分子(例如Nrf2、Nox1、STAT3)[21]。
氢气是一种特定的•OH和ONOO−清除剂,这两种都是非常强的氧化剂,它们会不加选择地与核酸、脂质和蛋白质反应,导致DNA断裂、脂质过氧化和蛋白质失活。然而,氢气不能与信号氧化剂如超氧阴离子、一氧化氮NO•、过氧化氢发生反应。氢气的给药减轻了各种氧化应激标志物的表达,如髓过氧化物酶、丙二醛、8-羟基脱氧鸟苷、8-异前列腺素F2a和硫代巴比妥酸活性物质,在所有人类疾病和啮齿动物模型中均有发现。最近的报告还揭示了,氢气选择性抗氧化在植物中减轻了某些病理过程,并在水果中保持了新鲜度[2, 10, 12, 21]。
我们选择透明质酸(HA)作为氧化降解的标志物,它是一种天然存在的非硫酸化糖胺聚糖(GAG)。它由重复的二糖单元[-D-葡萄糖醛酸-β-1,3-N-乙酰-D-葡糖胺-β-1,4-]n生物聚合物组成,是细胞外基质的关键成分。这种GAG广泛分布在脊椎动物的组织和液体中。它具有显著的物理化学和生物学特性。组织中HA的含量各不相同,人体关节滑膜液、玻璃体、皮肤和大脑中的HA浓度最高。在健康个体中,HA由10,000个二糖单元组成,对应高达40,000 kDa。
HA链在低浓度下倾向于纠缠,表现出粘弹性行为,即在低频时它们表现为粘性液体,在高频时表现出弹性行为。在体内,HA的降解可能源于羟基自由基、过氧亚硝酸盐和次氯酸根离子,并且在炎症中可能会增强。羟基自由基可以提取N-乙酰氨基己糖上除了C-2之外的所有环C-H键上的氢原子。提取氢原子会产生碳中心自由基。形成糖苷键的碳上的自由基会经历β-裂解反应,导致HA链的断裂[22, 23]。
本研究的目的是评估比较水中饱和氢气和商用富氢水的自由基清除特性。
材料和方法
材料
从Lifecore Biomedical, Chaska, MN, USA购买的透明质酸钠(Mw 1.67 MDa)。抗坏血酸、2,2-二苯基-1-苦基肼和甲醇购自Merck KGaA, Darmstadt, Germany。NaCl和CuCl2 p.a.购自Slavus Ltd., Bratislava, Slovakia。亚甲蓝来自Mikrochem, Pezinok, Slovakia。氢气产生片剂(饮用富氢水)获得自RHW Natural Health Products Inc. New Westminster BC, Canada。超浓缩氢渗透反渗透(RO)水获得自ProLife Group, Ltd., Bratislava, Slovakia,可饮用且蒸馏水中饱和了氢气。使用TKA水净化系统生产的去离子高纯度等级水,电导率≤0.055 μS/cm。
DPPH测定法
通过将2,2-二苯基-1-苦基肼(1.1 mg)溶解在50 mL的甲醇中制备DPP•。将不同来源的氢气水(1 mL)加入到DPP•(2 mL)中,并在517 nm波长下进行10或15分钟的动力学测量。
旋转粘度计法
将透明质酸钠(1.75 mg/mL)溶解在0.15 M的NaCl水溶液中,分两步进行:首先,向14 mg HA中加入4.0 mL溶剂。6小时后,再加入3.9或2.9 mL的0.15 M NaCl。还制备了抗坏血酸(16 mM)和氯化铜(160 µM)的储备溶液。氢气产生片剂溶解在可饮用或蒸馏水(330 mL)中。
通过CuCl2(1 µM)和抗坏血酸(100 µM),即活性氧物种的来源,以以下方式启动HA的降解:将CuCl2储备溶液(50 µL)加入到HA溶液(7.9 mL)中,搅拌0.5分钟。不搅拌溶液7.5分钟后,将抗坏血酸储备溶液(50 µL)加入到HA溶液中并再次搅拌0.5分钟。然后将最终溶液立即转移到粘度计的特氟龙®容器中。
检验氢气水作为HA降解抑制剂效果的程序如下:
(a) 将CuCl2储备溶液(50 µL)加入到HA溶液(6.9 mL)中,搅拌0.5分钟。然后静置7.5分钟不搅拌。接着,加入含氢气水(1 mL),并再次搅拌0.5分钟。最后,加入抗坏血酸储备溶液(50 µL),并搅拌0.5分钟。随后立即将混合溶液转移到旋转粘度计的特氟龙®容器中。
(b) 将CuCl2储备溶液(50 µL)加入到HA溶液(6.9 mL)中,搅拌0.5分钟。然后静置7.5分钟不搅拌。之后,加入抗坏血酸储备溶液(50 µL),并搅拌1小时。最后,加入含氢气水(1 mL),并再次搅拌0.5分钟。
使用旋转粘度计的Rheocalc程序,测量HA溶液的动态粘度5小时,每3分钟记录一次数据。其他参数为:温度25°C,粘度计特氟龙®转子速度180 rpm,剪切率等于237 s−1。
结果与讨论
评估氢原子转移特性有几种方法。其中之一是DPPH测定法(图22.1)。
DPP∙+H→DPPH
图22.1 DPP•的结构
这种方法的缺点是DPPH在乙醇或甲醇中的溶解度,以及DPP•自由基在人体中不存在的事实。
如图22.2所示,无论是溶解在反渗透水中的氢气(1 mL, 80 μM, 三角形),还是饱和在可饮用或蒸馏水中的氢气(1 mL, 190 μM, 分别为灰色和白色圆圈),在清除DPP•方面均无效。
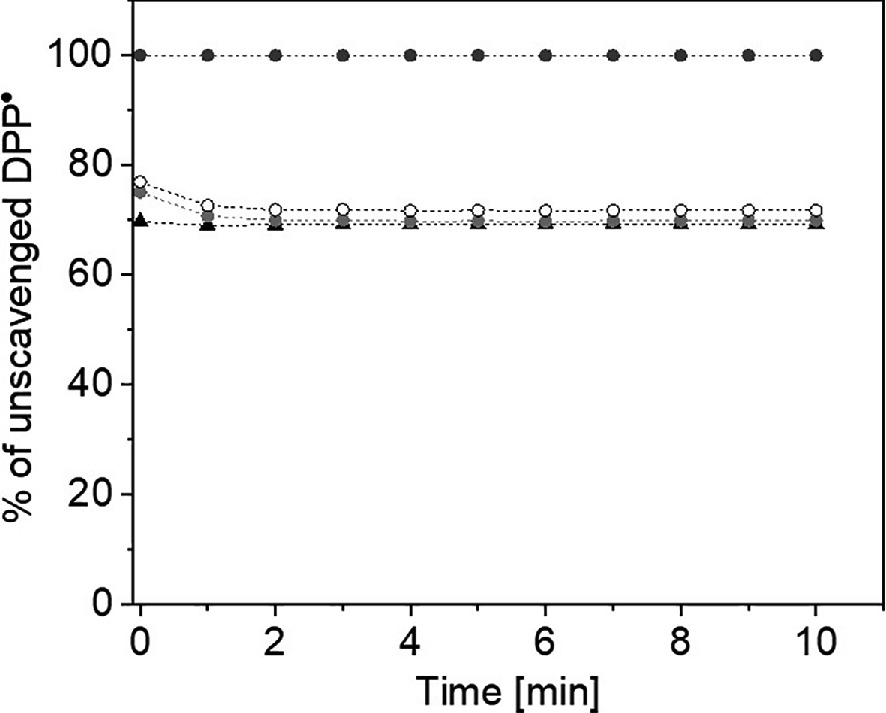
图22.2 显示了未被清除的DPP•(黑圈)的百分比,由溶解在RO水中的氢气(80 µM,三角形)、饱和在饮用水中的氢气(190 µM,灰色圈)以及饱和在蒸馏水中的氢气(190 µM,白圈)处理。
图22.3的左侧结果表明,溶解在饮用水中的氢气片剂在部分清除DPP•方面是有效的(黑圈)。未被清除的DPP•的百分比从0分钟时的78%下降到15分钟后的38%(白三角)。饮用水本身(黑三角)、从片剂中释放出的氢气(黑方块)、从片剂中释放出并重新饱和氢气的氢气(白圈)都无法清除DPP•。右侧面板观察到类似的结果。只有当添加溶解在蒸馏水中的氢气片剂时,才观察到积极的效果,其中未被清除的DPP•的百分比从0分钟时的74%下降到15分钟后的35.8%。
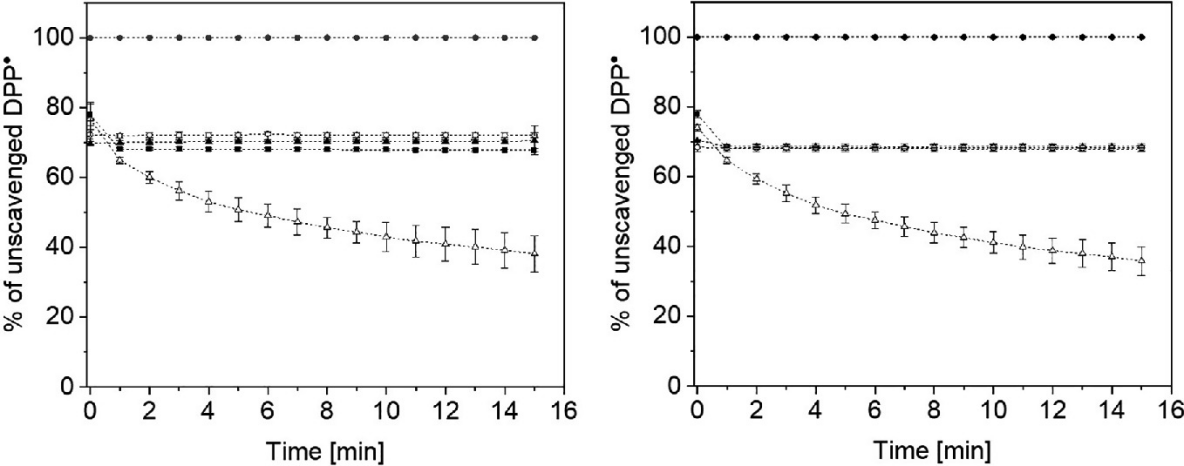
图22.3 显示了未被清除的DPP•(●)的百分比,由氢气片剂溶解在水中(190 µM, Δ)、水(▲)、从片剂中释放出的氢气(■)、从片剂中释放出并重新饱和氢气的氢气(130 µM, ◯)。左面板:氢气溶解在饮用水中,右面板:氢气溶解在蒸馏水中。实验进行了三次重复。
Fan等人[24]证实了我们的结果,即富氢水在4 mL体积下清除DPP•的效果很差(4 mL)。富氢水的功效为6%。
我们一直在应用由铜离子和抗坏血酸组成的氧化系统,这是活性氧物种如•OH、烷氧基、烷过氧型自由基的来源,这些自由基会破坏包括多糖透明质酸在内的所有分子。透明质酸容易受到氧化降解,而许多具有氢原子供体特性的抗氧化剂或药物的保护效果已被证明[25,26,27]。这种氧化系统代表了病理生理条件,并在人体中发生。我们使用的方法包括旋转粘度计法,该方法监测透明质酸溶液的动态粘度值随时间的变化。
图22.4的左侧面板结果显示,透明质酸在活性氧物种的作用下降解了9.1 mPa·s(黑线)。如图所示,以75 µM浓度溶解在饮用水中的氢气(灰线)部分保护了透明质酸分子免受•OH诱导的降解。5小时内,透明质酸溶液的动态粘度下降了3.0 mPa·s。我们小组的新发现是氢气也能够适度清除烷氧基和烷过氧型自由基的能力(右侧面板)。透明质酸显示出轻微的降解,而透明质酸溶液的动态粘度在4小时内下降了4.15 mPa·s。
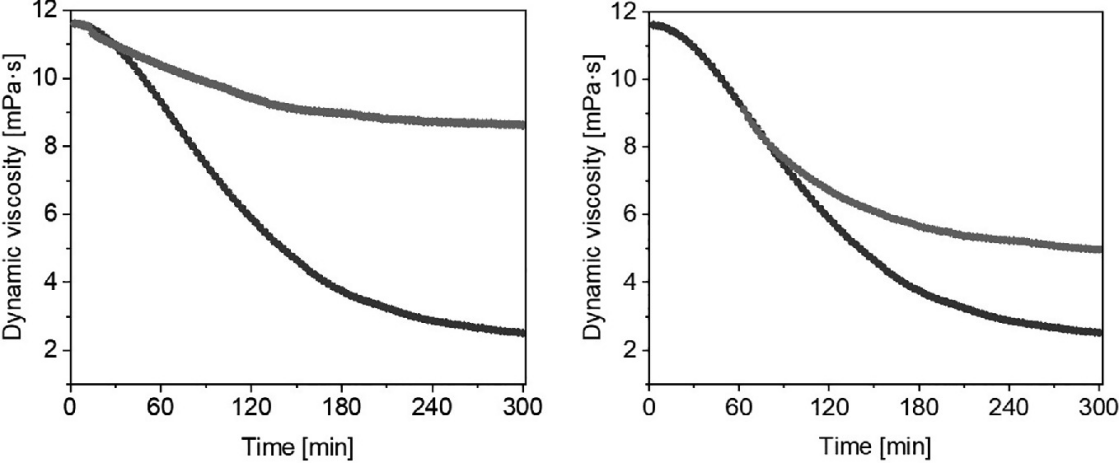
图22.4 显示了暴露于1 μM Cu(II)和100 μM抗坏血酸的透明质酸溶液的动态粘度随时间的变化(黑线)。在实验开始前(左,改编自Kura等人[28])和1小时后(右)添加溶解在饮用水中的氢气(75 μM,灰线)。
如图22.5中的结果显而易见,溶解在蒸馏水中的氢气(75 μM,灰线)在抑制•OH以及烷氧基和烷过氧型自由基诱导的透明质酸降解方面的效果不如图22.4中的结果。动态粘度值分别下降了6.47(左)和4.95 mPa·s(右)。
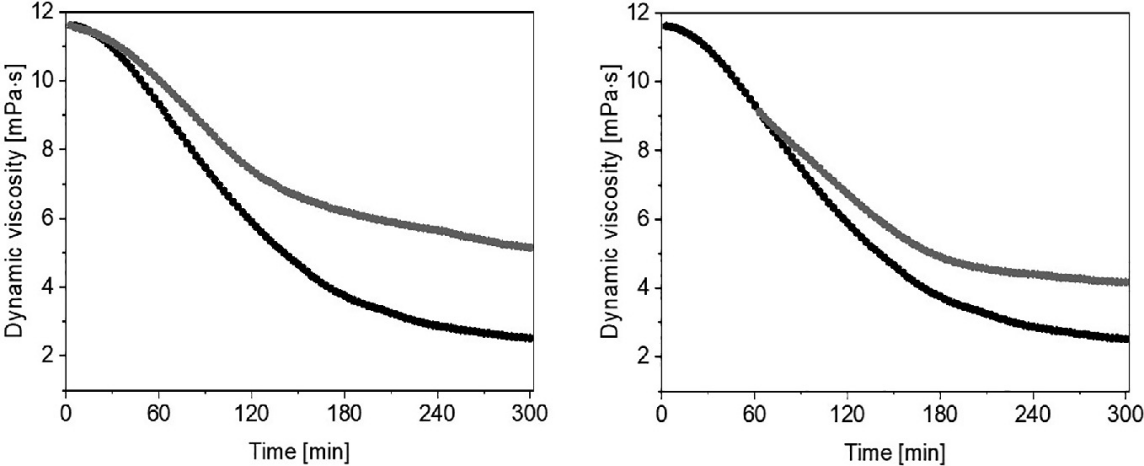
图22.5显示了暴露于1 μM Cu(II)和100 μM抗坏血酸的透明质酸溶液的动态粘度随时间的变化(黑线)。在实验开始前(左)和1小时后(右)添加溶解在蒸馏水中的氢气(75 μM,灰线)
图22.6的结果表明,商业上使用的超高度浓缩的氢注入RO水在80 µM浓度下略微清除了•OH(左)。然而,商业氢水对烷氧基和烷过氧型自由基的保护效果并未显现(右)。
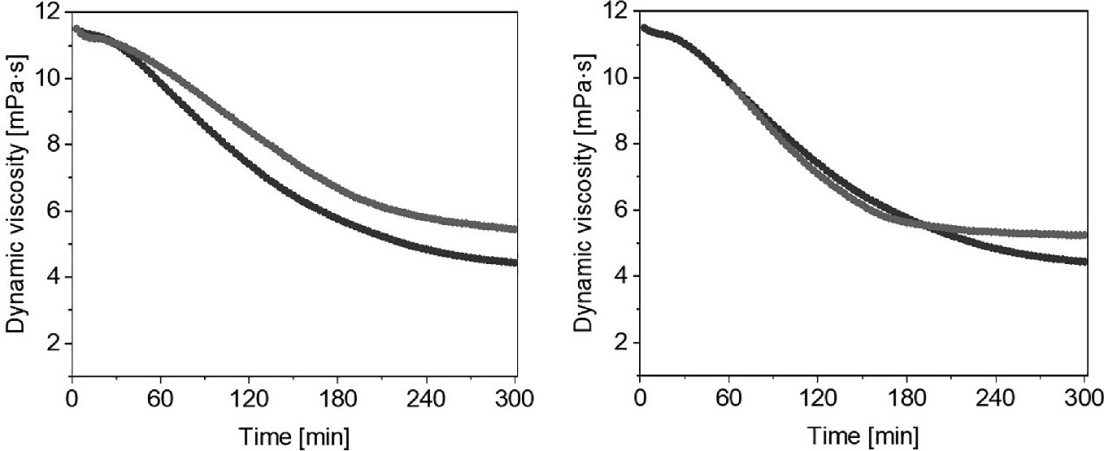
图22.6 显示了暴露于1 μM Cu(II)和100 μM抗坏血酸的透明质酸溶液的动态粘度随时间的变化(黑线)。在实验开始前(左)和1小时后(右)添加超高度浓缩的氢注入RO水(80 μM,灰线)。
此外,我们还检验了另一种商业制品Drink 富氢水,其中的氢气由活性成分金属镁(80 mg)产生,它与水反应生成氢气气体和氢氧化镁,反应式为:Mg + 2H2O → H2(g) + Mg(OH)2。片剂中还含有有机酸如苹果酸和酒石酸,它们中和Mg(OH)2并催化反应速率[21]。
如图22.7左所示,首先将透明质酸溶液暴露于1 μM Cu(II)离子和100 μM抗坏血酸作为活性氧物种的来源。在5小时内,透明质酸降解了7.07 mPa·s(黑圈)。添加1 mL溶解在饮用水中的氢气片剂(190 μM)导致显著的•OH自由基诱导的透明质酸降解,这在2小时内最为明显。5小时测量后,透明质酸溶液的动态粘度下降了8.3 mPa·s(黑方)。这种大规模的透明质酸降解是由于苹果酸和酒石酸的存在。Ye等人[29]使用EPR方法在Cu(II)/酒石酸/H2O2体系中检测到了超氧阴离子、碳中心自由基(•R)和H•,这些促进了Cu(II)/Cu(I)红ox循环。Cabelli和Bielski [30]使用脉冲辐解技术进行了•OH和苹果酸之间的反应,他们展示了当苹果酸与•OH相互作用时,形成了α-苹果酸自由基。添加溶解在饮用水中的氢气片剂并将氢气气泡排出(白三角),与对照相比,透明质酸的降解速度稍快。然而,即使以220 μM的浓度重新饱和这种水,对抑制透明质酸降解的影响也微乎其微(黑三角)。作为对比,我们还检验了饮用水本身的效果,其中最快降解发生在1小时内,随后透明质酸的降解显著减慢(白圈)。
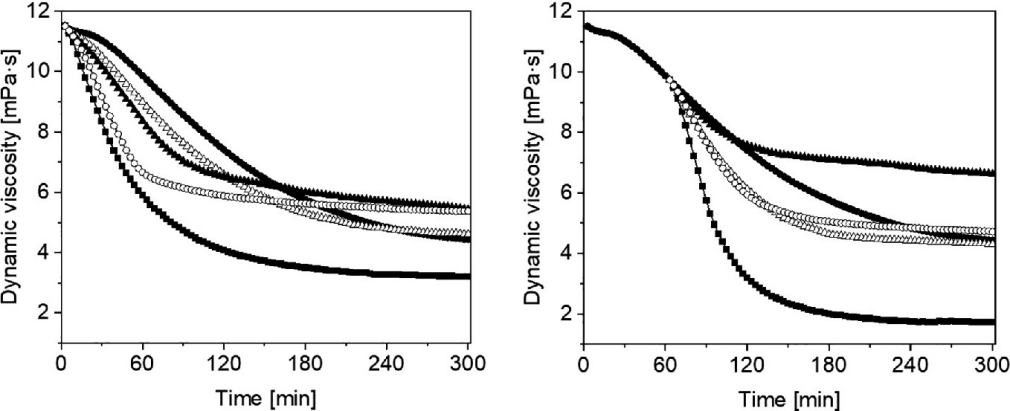
图22.7 显示了透明质酸溶液在1 μM Cu(II)离子和100 μM抗坏血酸的氧化降解作用下,动态粘度随时间的变化(●)。添加溶解在饮用水中的氢气片剂(1 mL)(■),从片剂中释放出的氢气(Δ),从片剂中释放出并重新饱和氢气的氢气(▲),饮用水(◯)。样品在实验开始时加入(左)或1小时后(右)。
当在透明质酸氧化降解开始1小时后添加溶解在饮用水中的氢气片剂(190 µM)时,观察到类似的结果(右)。再次记录到透明质酸溶液动态粘度大幅下降8.0 mPa·s(黑方)。添加溶解在饮用水中的氢气片剂并排出氢气后,以及仅添加蒸馏水,都以类似的方式降低了透明质酸的降解速率(分别用白三角和白圈表示)。然而,用氢气(160 µM)重新饱和这些水对烷氧基和烷过氧型自由基诱导的透明质酸降解有积极影响。粘度降低了3.31 mPa·s(黑三角)。
图22.8 中的结果显示,添加1 mL溶解在蒸馏水中的氢气片剂(125 μM)导致•OH诱导的透明质酸降解更快(黑圈),与饮用水的结果相比。测量5小时后,透明质酸溶液的动态粘度下降了8.48 mPa·s(黑方)。添加溶解在蒸馏水中的氢气片剂并移除氢气,与黑方曲线相比,轻微促进了透明质酸的降解(白三角)。另一方面,添加用氢气(125 μM)重新饱和的水减弱了透明质酸的降解。透明质酸溶液的动态粘度下降了6.88 mPa·s(黑三角)。作为对比,我们还检验了蒸馏水本身的效果,其效果比黑三角曲线稍弱(白圈)。
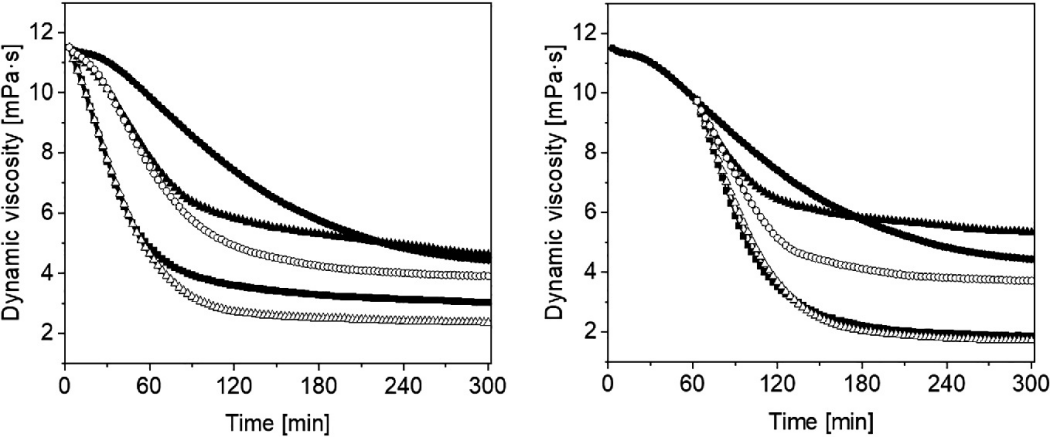
图22.8 显示了透明质酸溶液在1 μM Cu(II)离子和100 μM抗坏血酸的氧化降解作用下,动态粘度随时间的变化(●)。添加溶解在蒸馏水中的氢气片剂(1 mL)(■),从片剂中释放出的氢气(△),从片剂中释放出并重新饱和氢气的氢气(▲),蒸馏水(◯)。样品在实验开始时加入(左)或1小时后(右)。
在透明质酸开始降解1小时后,溶解在蒸馏水中的氢气片剂(与图22.7中的结果相比)显示出更显著的促氧化效果(右)。当检验从片剂中溶解在蒸馏水中的氢气以及排出氢气后的水时,显示出非常相似的结果(黑方和白三角曲线分别表示)。然而,用氢气(125 μM)重新饱和这些水对烷氧基和烷过氧型自由基诱导的透明质酸降解有最小的恶化效果。粘度降低了4.4 mPa·s(黑三角)。
Kura等人[31]使用Drink 富氢水片剂获得了不同的结果,他们以随机、双盲、安慰剂对照的方式,给30名患有非酒精性脂肪肝病的个体服用富氢水达8周。从表型上,他们观察到富氢水组的体重(约1公斤)和体质指数有所下降。富氢水被良好地耐受,肝脏酶没有显著变化,改善了脂质谱并降低了乳酸脱氢酶水平。富氢水非显著性地降低了核因子kappa B、热休克蛋白70和基质金属蛋白酶-9的水平。然而,在富氢水组中观察到8-羟基-2'-脱氧鸟苷和丙二醛水平的轻度增加。
LeBaron等人[21]检验了急性补充富氢水(13 ppm)对19名个体的运动表现的影响,通过呼吸交换比、心率和呼吸频率进行测量。作者们展示了,在年轻健康个体中,氢气的给药并没有促进最大运动表现;然而,它显著降低了次最大强度运动时的心率。
在远古时代,地球大气中包含了丰富的氢气分子等多种气体成分。宇宙射线、γ射线以及其他落在大气上层的辐射为氢气分子分裂成两个氢原子的反应提供了足够的能量。氢原子是一个反应性自由基元素,它与许多化合物发生强烈的相互作用。
然而,在常见的生物源条件下,氢气的解离需要大量的能量,以至于从其分子形成两个氢原子几乎不可能。在有机化学中,如果化学反应中氢的解离是可能的,那么同时也假设存在某些生物源过渡金属,如Fe(II)/Fe(III),Cu(II)/Cu(I),Co(II)/Co(III),Ni(II)/Ni(III)和Mn(II)/Mn(III)。这些过渡金属离子的存在无疑负责了众多氧化还原活性酶的催化活性。
考虑在较高氧化态的过渡金属离子存在下,氢气分子均相解离成H加上H的起点是以下假设的还原反应:
Men+1+H•→Men+H+
然而,这个反应可能导致酶中金属离子的不可逆还原,这被认为是次要的。
在《氢气在健康与疾病中的作用》一书,特别是Ohta所著的“氢气医学和生物学的出现、发展和未来使命”一章中,作者基于他关于氢气在生物体中清除效应的众多科学论文,选择了一个最有可能的生物源试剂——即氧化卟啉铁(PrP-Fe(III)-OH)及其还原功能形式(即PrP-Fe(II))。显然,选择金属卟啉蛋白是最合理的,以建议下面标记的反应方案。
在第一步中,卟啉的氧化形式参与催化氢气的解离,形成卟啉的氢化物形式和水分子。
PrP-Fe(III)-OH+H2→PrP-Fe(III)-H+H2O
然而,正是所形成的产物,即卟啉的氢化物形式,与自由基−R•发生反应,后者对于抽氢原子H•具有足够的反应性,以形成分子−R-H [33]。 由于高反应性的自由基包括具有高正标准电极电势Eo´的自由基,我们可以考虑在生物系统中−R•将是例如•OH、烷氧基、烷过氧基,其Eo´分别为2310、1600和1000 eV。 Ohta在其论文《氢气医学和生物学的出现、发展和未来使命》中提到:“在病理条件下,卟啉被氧化损伤,氢气可以通过修复卟啉来激活不同类型的卟啉酶。因此,氢气可以表现出许多功能。重要的是,氢气只在氧化损伤的卟啉上发挥作用,并且氢气不对功能性卟啉起作用。换句话说,氢气只在病理条件下发挥作用[33]。”正如我们在图22.4、22.5和22.6中的实验所展示的,富含氢气的水抑制了生物源高分子量透明质酸的自由 radical 降解,即在反应混合物中清除了•OH、烷氧基、烷过氧基自由基[28]。一个了解情况的读者可能会问,为什么图22.7和22.8中显示的不是氢气片剂提供的抗氧化效果,而是促氧化效果。然而,在溶解氢气片剂后,显然有一些游离的有机酸如苹果酸和酒石酸过量。尽管这些酸不与机体中的任何目标物相互作用,但在酸性条件下进行的透明质酸反应导致了其大分子的促进降解。 结论 在本章中,作者想要指出的事实是,上述形式的卟啉在急性和慢性炎症中是合理的,但我们使用了Weissberger生物源氧化系统(WBOS),这是一个类似的氧化还原环境,在反应中抑制了氢气对透明质酸降解的抑制(方案22.1)。
H2O2+[Cu(I)---complex]→∙OH + HO−+[Cu(II)---complex]
方案22.1
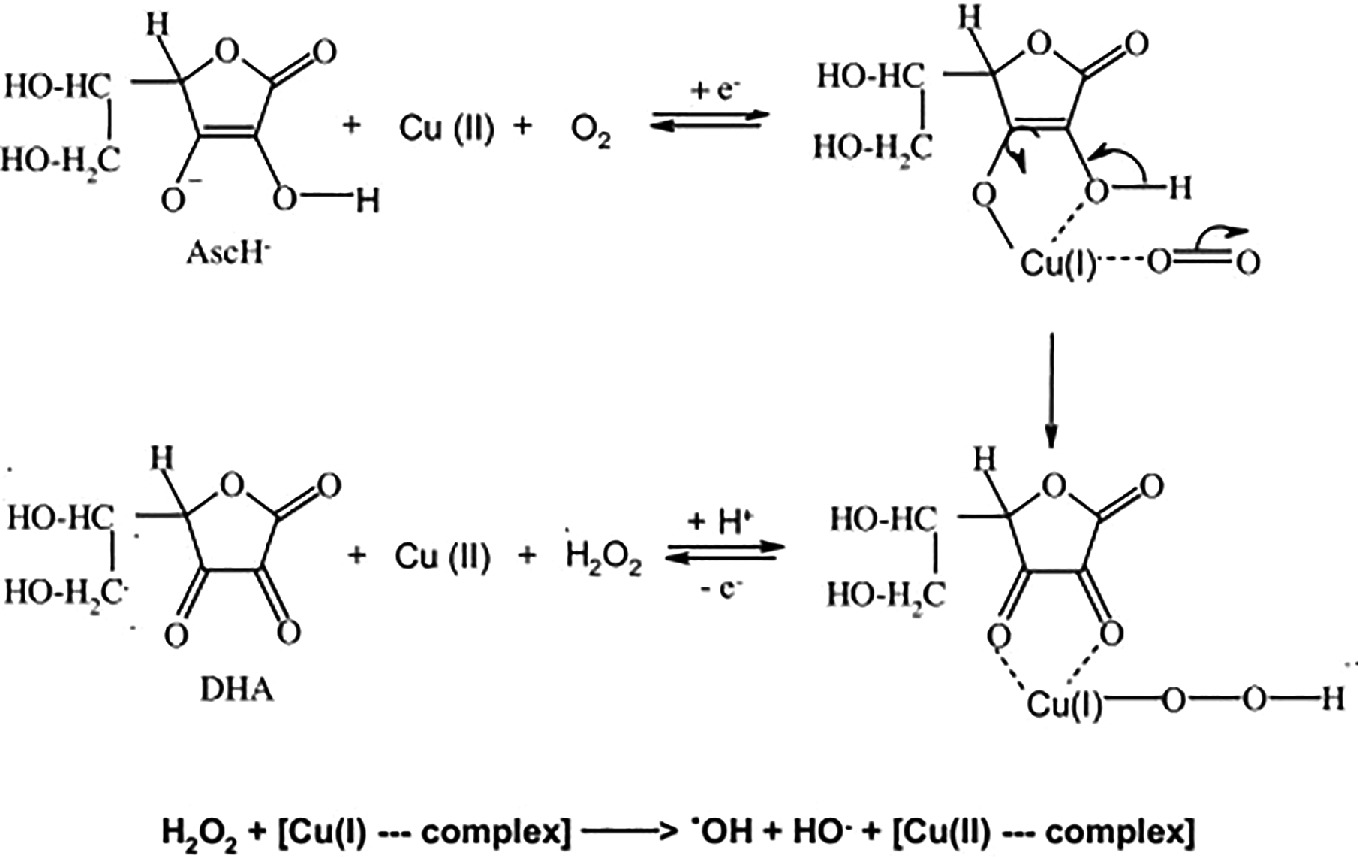
魏斯伯格生物源氧化系统的化学 在WBOS中,作为过渡金属离子的是Cu(II)/Cu(I),在体内条件下,它不与卟啉络合,而是在我们的体外条件下,由与抗坏血酸络合的铜离子出色地完成(参见方案22.1)。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://blog.sciencenet.cn/blog-41174-1431763.html
上一篇:支原体如何入侵到细胞内