近年来,越来越多的研究表明长期压力可以诱导外周和脑内炎症反应的发生,进而导致行为学改变与精神障碍(如抑郁和焦虑)[1-2]。这些炎症性变化包括:肠道菌群、外周免疫细胞和炎症因子的改变[3]。
此外,我们也知道肠道免疫系统可以通过肠脑轴来调控神经系统[4],那么,长期压力是否也可以通过改变肠道免疫系统来促进病理性神经行为学的发生呢?
近日,来自霍普金斯大学的Atsushi Kamiya研究组发现,长期压力会致使肠道菌群中的乳酸菌大量减少,而这促进了肠道γδT细胞的增殖/分化,并迁移至大脑,进而引发抑郁神经行为学的发生[5]。
这项重要的研究工作发表在Nature Immunology上。
论文题目及作者
这篇研究工作主要基于小鼠抑郁模型——“慢性社交失败压力(CSDS)”模型[6]。
由于CSDS模型较好地模拟了长期精神压力导致的人类行为改变,因此常用于研究长期社交压力对行为、生理和神经免疫等方面的影响。
这个模型通过让一只小鼠长期与一只更强壮的“入侵者”小鼠进行社交互动,以模拟社交情况。有的小鼠可以适应这种应激,称之为适应组,有的小鼠则会呈现出社交失败情况,并且出现行为(如抑郁)和生理上的变化,称之为易感组。
那下面就跟着奇点糕来仔细看一下他们是如何展开研究的吧。
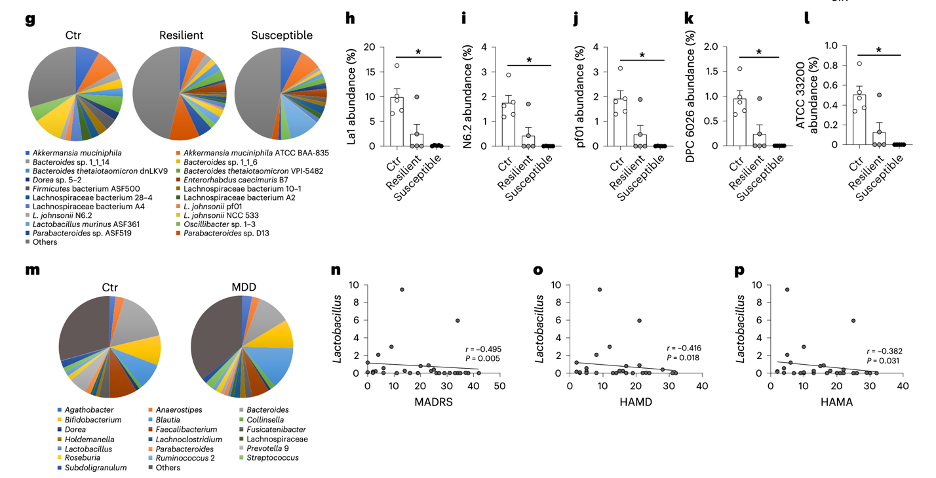
首先,Kamiya团队分析了CSDS应激后的小鼠肠道菌群。他们发现,与对照组(无CSDS)和适应组相比,易感组小鼠的肠道菌群多样性显著下降,并且乳酸菌的数量也显著降低。
为了证实这个发现的转化意义,他们接着分析了与CSDS小鼠模型相关的重度抑郁障碍(MDD)患者的肠道菌群。结果显示,这些患者的乳酸菌含量与MDD各种评分均呈负相关,也就是说MDD评分越高,肠道乳酸菌含量越低。
因此,CSDS小鼠模型和MDD患者的数据都表明,乳酸菌可能与个体压力承受能力和抑郁精神病理学密切相关。
CSDS易感组小鼠和MDD患者的肠道乳酸菌减少
由于先前的多项研究发现肠道菌群变化会引起肠道免疫系统的变化,尤其是T细胞免疫反应的改变,而乳酸菌与结肠处Treg的分化密切相关[7]。因此,Kamiya团队接下来探究了CSDS之后肠道T细胞的变化。
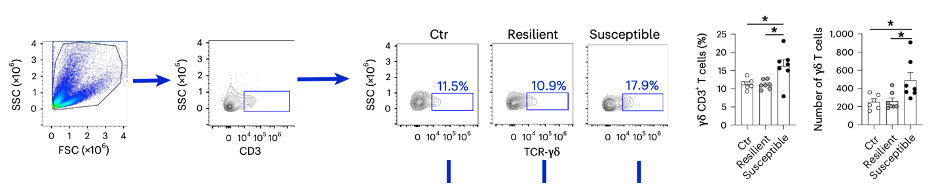
通过流式细胞术,他们发现,与对照组和CSDS适应组相比,CSDS易感组小鼠结肠的黏膜基底层处的γδT细胞和γδ17 T细胞的数量显著升高。有意思的是,这个现象只见于结肠,小肠和脾脏处的γδT细胞和γδ17 T细胞的数量并没有区别。
鉴于硬脑膜处的γδT细胞曾被报道与稳态中大脑功能和小鼠行为密切相关[8],因此他们接着检测了CSDS之后硬脑膜γδT细胞的变化。流式细胞术表明,与结肠处的改变类似,CSDS易感组小鼠硬脑膜处γδT细胞和γδ17 T细胞的数量,显著高于对照组和CSDS适应组。
CSDS易感组小鼠硬脑膜处γδT细胞显著增加
以上的发现表明,CSDS易感组小鼠肠道乳酸菌减少,于此同时结肠处γδT细胞和γδ17 T细胞的数量显著升高。既然多项研究曾报道肠道菌群可以调控T细胞,那么,在CSDS易感组中,乳酸菌的减少是否促进了CSDS引发的抑郁行为,以及γδT细胞和γδ17 T细胞的数量改变呢?
Kamiya团队发现,口服乳酸菌可以抑制CSDS小鼠的结肠处γδT细胞和γδ17 T细胞的数量增加,并且还可以增加小鼠对CSDS的适应能力。
接下来,他们探究了为何硬脑膜处的γδT细胞和γδ17 T细胞数量会产生变化。由于先前的研究报道,中风会致使肠道菌群失调,而后者可以通过肠道Treg细胞来促进γδ17 T细胞的分化及向硬脑膜的迁移[8]。因此,他们检测了CSDS之后硬脑膜的γδT细胞的来源情况。
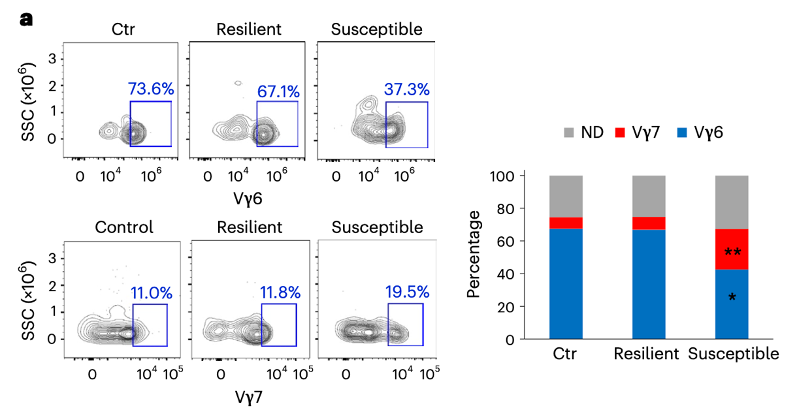
由于硬脑膜固有的γδT细胞通常表达Vγ6,而肠道γδT细胞则表达Vγ7。因此,可以通过流式细胞术来区分CSDS之后硬脑膜处的γδT细胞是从哪里来的。
他们发现,在CSDS易感组小鼠中,硬脑膜固有的Vγ6+γδT细胞数目下降,而来自肠道的Vγ7+γδT数量则增加,这也就说明CSDS易感小鼠硬脑膜处的γδT细胞从肠道迁移而来。而当他们特异性抑制肠道γδT细胞的时候,CSDS小鼠硬脑膜处的γδT细胞数量不再增加,并且这些小鼠对于CSDS也呈现出更高的适应性。
CSDS易感组小鼠硬脑膜处γδT细胞主要来源于肠道
接下来,通过TCRd-KO模型和免疫细胞移植技术,Kamiya团队证实了外周的γδ17 T细胞是CSDS在易感组小鼠中诱导抑郁相关行为所必需的。
那么,乳酸菌的减少是如何促进肠道γδT细胞的增殖和γδ17 T细胞的分化呢?
由于乳酸菌可以分解真菌来源的β-葡聚糖多糖,而属于模式识别受体的dectin-1负责识别真菌来源的β-葡聚糖多糖。鉴于CSDS易感小鼠肠道乳酸菌数目减少,他们猜测CSDS应激会导致肠道dectin-1表达产生变化。
通过流式细胞术,他们发现CSDS易感组小鼠肠道dectin-1表达上调,并且这种改变主要是来源于γδT细胞——与对照组和CSDS适应组相比,CSDS易感组小鼠中dectin-1+γδT细胞数量显著增加。这个结果说明CSDS可以促进γδT细胞上调dectin-1水平。
接着,通过dectin-1敲除模型,他们发现CSDS诱导的dectin-1的上调促进了γδ17 T细胞的分化和神经行为学的改变。接着,通过一系列的免疫细胞移植技术,他们证实了γδT细胞上的dectin-1是CSDS易感组小鼠产生抑郁行为不可缺失的重要因素。
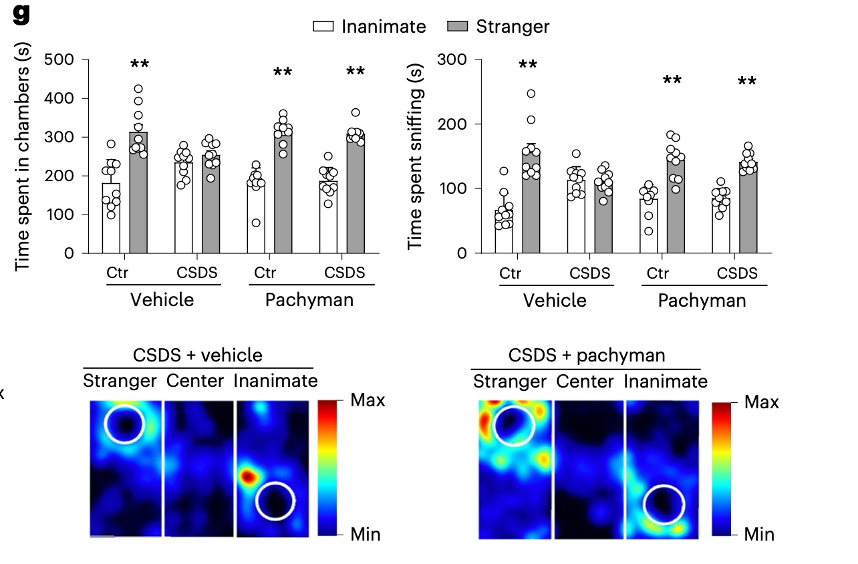
鉴于以上发现,作者们最后测试是否可以通过药物调控dectin-1分子,而改变CSDS诱导的抑郁行为。他们给小鼠服用了一种叫做pachyman的来自腐生菌类多孔菌(又称茯苓)的β-葡聚糖多糖。Pachyman也是抑郁症的辅助治疗方法。结果证明,pachyman不仅可以抑制CSDS导致的结肠γδT细胞的增加,还可以逆转CSDS导致的抑郁相关的行为。
Pachyman 可以逆转CSDS导致的抑郁行为
总的来说,这篇研究表明长期压力可以导致易感个体出现肠道菌群失调和乳酸菌数量下降的现象,而这会促进肠道γδT细胞和γδ17 T细胞上的增加,这些细胞会迁移到硬脑膜处,进而促进神经病理和抑郁相关的行为的发生。
他们还阐明了这是目前抑郁症辅助治疗pachyman的起效机制之一,并且证明了pachyman可以逆转CSDS导致的抑郁行为。
参考文献:
[1]. McKim DB, Weber MD, Niraula A, et al. Microglial recruitment of IL-1β-producing monocytes to brain endothelium causes stress-induced anxiety. Mol Psychiatry. 2018;23(6):1421-1431. doi:10.1038/mp.2017.64
[2]. Nie X, Kitaoka S, Tanaka K, et al. The Innate Immune Receptors TLR2/4 Mediate Repeated Social Defeat Stress-Induced Social Avoidance through Prefrontal Microglial Activation. Neuron. 2018;99(3):464-479.e7. doi:10.1016/j.neuron.2018.06.035
[3]. Pearson-Leary J, Zhao C, Bittinger K, et al. The gut microbiome regulates the increases in depressive-type behaviors and in inflammatory processes in the ventral hippocampus of stress vulnerable rats. Mol Psychiatry. 2020;25(5):1068-1079. doi:10.1038/s41380-019-0380-x
[4]. Cryan JF, O’Riordan KJ, Cowan CSM, et al. The Microbiota-Gut-Brain Axis. Physiol Rev. 2019;99(4):1877-2013. doi:10.1152/physrev.00018.2018
[5]. Zhu X, Sakamoto S, Ishii C, et al. Dectin-1 signaling on colonic γδ T cells promotes psychosocial stress responses [published online ahead of print, 2023 Mar 20]. Nat Immunol. 2023;10.1038/s41590-023-01447-8. doi:10.1038/s41590-023-01447-8
[6]. Wang W, Liu W, Duan D, Bai H, Wang Z, Xing Y. Chronic social defeat stress mouse model: Current view on its behavioral deficits and modifications. Behav Neurosci. 2021;135(3):326-335. doi:10.1037/bne0000418
[7]. Tang C, Kamiya T, Liu Y, et al. Inhibition of Dectin-1 Signaling Ameliorates Colitis by Inducing Lactobacillus-Mediated Regulatory T Cell Expansion in the Intestine. Cell Host Microbe. 2015;18(2):183-197. doi:10.1016/j.chom.2015.07.003
[8]. Benakis C, Brea D, Caballero S, et al. Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells. Nat Med. 2016;22(5):516-523. doi:10.1038/nm.4068
来自: 奇点神思
更多阅读: